Calcular Gramos De Reactivo En Exceso
Cálculos Estequiométricos Reactivo Límite Exceso Youtube. Relación peso-peso relación pesovolumen reactivo limitante reactivo en exceso grado de conversión o rendimiento.

Reactivo Limitante Y En Exceso Gramos Youtube
Aqui encontraras la mejor explicación de un ejercicio en el que se calculan cantidades de reacción teniendo en cuenta el reactivo limite y exceso en gramos.
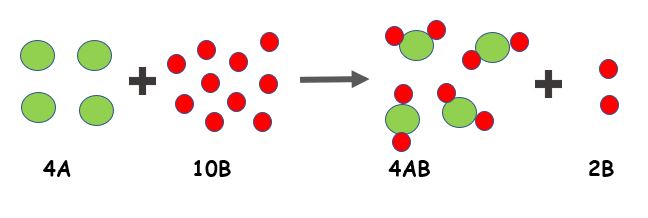
Calcular gramos de reactivo en exceso. Calcula los gramos que sobran del reactivo en exceso y la masa de amoniaco que se obtiene. Suponga que se mezcla 6372gr de Amoniaco NH3 con 114gr de CO2 Cuántos gramos de urea NH2 2 CO se obtendrán. Es decir es un sobrante en la reacción Ejemplo.
Como el reactivo limitante es el hierro determinamos la cantidad estequiométrica de estibnita necesaria para reaccionar con los 250 gramos de hierro. La cantidad máxima de producto que se puede producir se llama el rendimiento teórico. Si partimos de 40 gramos de hidrógeno y 300 gramos de nitrógeno calcular.
El porcentaje de reactivo en exceso se calcula para la estibnita reactivo en exceso suponiendo que reacciona todo el reactivo limitante. Cuando conoce el reactivo en exceso puede calcular las cantidades finales tanto del producto como del. Si reaccionan 49 gramos de CO y 40 gramos de O 2Indicar quien es el reactivo en exceso y el reactivo limitante.
C12 O16 2 CO O 2 2CO 2. 047 mol CH 4 reaccionan exactamente con 047 g de O 2 como se dispone de 15 g O 2 quedara en exceso de O 2 103 g indicando que el reactivo limite es el CH 4. Calcula los gramos que sobran.
B El reactivo en exceso es aquel del cual tenemos más de lo necesario para que se lleve a cabo la reacción química. La ecuación nos indica la proporción 1 mol de CH 4 reacciona con 2 moles de O 2. Sea la siguiente ecuación.
Conocer el reactivo en exceso ayuda a garantizar que pueda calcular con éxito las cantidades finales de reactivo y producto así como las concentraciones iónicas. Del reactivo en exceso y la masa de amoniaco que se obtiene. 3 En síntesis del amoniaco reaccionan 10 gr de H2 con 50 gr de N2.
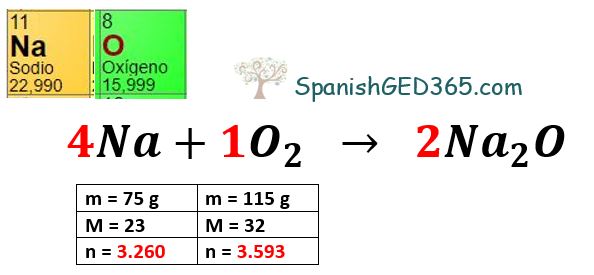
El reactivo limite se define como la sustancia que se consume totalmente en el curso de una reacción química mientras que el reactivo en exceso es el reac. Explicación fácil y paso a paso de cómo obtener el reactivo limitante el reactivo en exceso en una reacción química así como el porcentaje de rendimiento o. Determina los reactivos limitantes y en exceso si hay 75 gramos de sodio y 115 gramos.
Convierta la cantidad de cada exceso de reactivo en gramos utilizando su peso molecular. En una reacción química los reactivos que no se usan cuando la reacción se completa se denominan reactivos en exceso. Datos Masas atómicas H 1.
Por lo tanto con los 375 moles de amoníaco se podrían obtener 1875 moles de urea. Por otra parte los Reactivos en Exceso son aquellos que van a sobrar cuando el reactivo limitante se consuma completamente. Cantidad de amoníaco formado.
6372 gramos de amoníaco son 375 moles. El valor de n es 2296 con este valor podemos obtener la masa en gramos multiplicando 2296 x 102 y nos da 234192 g. Reactivo limite y en exceso hay muchas maneras de hallar el reactivo limite y el reactivo en exceso pero en este video te explican la manera que en nuestra opinion es la mas facil.
Con los 26 moles de dióxido de carbono se obtendrían 26 moles de urea. Volumen de amoníaco formado medido a 30 ºC y 3 atmósferas de presión. En una reacción química los reactivos que no se usan cuando la reacción se completa se denominan reactivos en exceso.
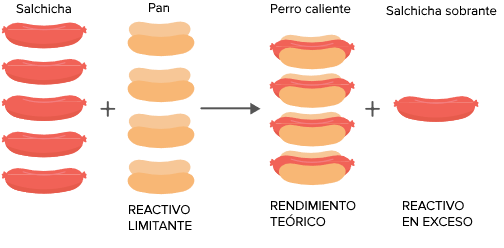
En el caso anterior el reactivo limitante es el jamón ya que al terminarse no se pueden seguir haciendo más emparedados. Con los valores dados. De acuerdo a la reacción.
Además indicar que cantidad de reactivo en exceso existe. Reactivo en exceso y que cantidad sobra. CaCO3 es el reactivo sólo exceso en este ejemplo la cantidad de CaCO3 es 100089 0061 6105 gramos.
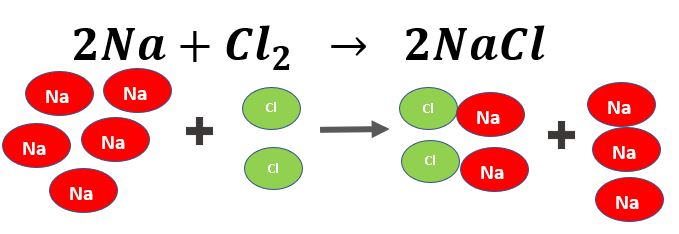
2alfe2o3 al2o32fe se hacen reaccionar 124g de al con 601g de fe2o3 determinar. El peso es igual al peso molecular multiplicado por el número de moles. A veces decimos que los otros reactivos están en exceso porque va a sobrar algo cuando el reactivo limitante se haya utilizado por completo.
Además el cálculo de las cantidades exactas de cada producto químico antes de mezclarlas garantiza que se logre una reacción completa de todos los materiales en la mezcla. Caco3 es el único exceso de reactivo en este ejemplo por lo que la cantidad de caco3 es 100089 0061 6105 gramos. El reactivo en exceso también conocido como reactivo en exceso es la cantidad de producto químico que queda después de una reacción completa.
Puedes seguir los mismos pasos para calcular la masa en gramos de 2Fe. A reactivo limitante reactivo en exceso la masa en gramos de AL2O3 que se formo RT y el R sabiendo RP250g. Reactivo en exceso-Sustancia que se encuentra en mayor cantidad y que cuando reacciona toda la sustancia limitante existe una cantidad de ella que no participa en la reacción.
Cómo calcular la cantidad de reactivo en exceso. 2 Calcular los gramos de ZnSO4 obtenidos al reaccionar 10 gr de Zn con 100 ml de H2SO4 2 M. El peso es igual al peso molecular multiplicado por el número de moles.
En una reacción química el reactivo limitante es el reactivo que determina cuánto producto se va a obtener. 4 Se hacen reaccionar 50 gramos de aluminio con 500 ml de una disolución de ácido. En el caso de los emparedados el reactivo en exceso son las rebanadas de pan ya que sólo se.
Se rige por el otro reactivo que se utiliza completamente y por lo tanto no puede reaccionar. Para mayor información se te sugiere leer el subtema 642 En este tipo de relación la sustancia dato se da en unidades de moles y la sustancia incógnita tambien se pide. El porcentaje en exceso de estibnita es del 1827.
N14 4 Se hacen reaccionar 50 gramos de aluminio con 500 ml de una disolución de ácido sulfúrico 2 M. La combustión de monóxido de carbono CO produce dióxido de carbono CO 2 de acuerdo a la siguiente reacciónPA. Quiere decir que la masa de Al 2 O 3 es igual a 234192g.
Para calcular el exceso de reactivo debe encontrar el peso molecular y luego calcular la molaridad. Convertir la cantidad de cada reactivo exceso gramos utilizando su peso molecular. 1142 gramos de dióxido de carbono son 26 moles.
En una Reacción Química el Reactivo Limitante es el que se consume antes y por lo tanto va a limitar la cantidad de los productos que se forman. Ya determinado el reactivo limite se procede a calcular la cantidad de producto que se produce justo con el mismo procedimiento. Aqui encontraras la mejor explicación de un ejercicio en el que se calculan cantidades de reacción teniendo en cuenta el reactivo limite y exceso en gramos.
Entonces en este caso el amoníaco es el reactivo limitante y el CO2 el reactivo en exceso. Calcula el volumen de gas hidrógeno que se obtiene en c n. Se hace reaccionar hidrógeno gaseoso con nitrógeno gaseoso para dar amoníaco también en forma gaseosa.

Reactivos Limitantes Y En Exceso Spanish Ged 365
Reactivos Limitantes Y En Exceso Spanish Ged 365

Reactivos Limitantes Y En Exceso Spanish Ged 365

Reactivo Limitante Y En Exceso Ejercicios Resueltos Trucos

Reactivo Limitante Y En Exceso Paso A Paso Youtube

Calculo Con Los Reactivos Limitante Y En Exceso Porcentaje De Rendimiento Y Cantidad Sin Reaccionar Youtube
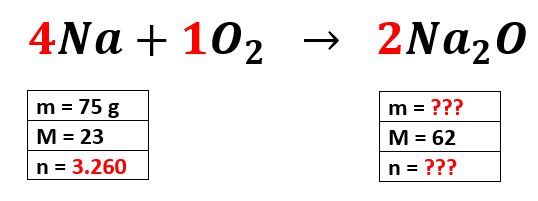
Reactivos Limitantes Y En Exceso Spanish Ged 365

Reactivo Limitante Problema De Ejemplo 1 Video Khan Academy
Proaltum Reactivo Limitante Y Rendimiento De Reaccion
Problemas De Estequiometria 2 Quimica Quimica Inorganica

Quimica Moralba Reactivo Limitante Y En Exceso

Estequiometria Calculos Con Reactivo Limite Y En Exceso Gramos Youtube
Profr Marcos Velazquez Reactivo Limitante Reactivo En Exceso Y Rendimiento De Reaccion Facebook

9 Estequiometria Cuanto Sobra Del Reactivo En Exceso Youtube
Reactivos Limitantes Y En Exceso Spanish Ged 365
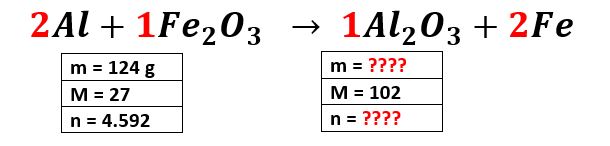
Reactivos Limitantes Y En Exceso Spanish Ged 365

Reactivo Limitante Y Reactivo En Exceso Problemas De Quimica General Para Universitarios
Reactivos Limitantes Y Rendimiento Porcentual Articulo Khan Academy

Reactivos Limitantes Y En Exceso Spanish Ged 365







Post a Comment for "Calcular Gramos De Reactivo En Exceso"